Fuerza: Denominamos fuerza a toda acción capaz de modificar el estado de reposo o de movimiento de un cuerpo. Las fuerzas son magnitudes vectoriales y para definirlas es necesario determinar su punto de aplicación, dirección, sentido e intensidad.
La intensidad de una fuerza se mide con un dinamómetro.
El dinamómetro consta de un resorte, con uno de sus extremos fijo y el otro desplazable libremente que posee un fiel que marca sobre una escala el estiramiento (o deformación) provocado por la fuerza que se aplica en el extremo libre.
Leyes de Newton:
1º Ley: Principio de Inercia: Todo cuerpo tiende a permanecer en el estado de reposo o de movimiento rectilíneo uniforme en que se encuentra, siempre que una fuerza extraña no modifique dicho estado.
2º Ley: Principio de masa: La aceleración adquirida por un cuerpo es directamente proporcional a la fuerza aplicada e inversamente proporcional a la masa de aquél.
3º Ley: Principio de acción y de reacción: A toda fuerza (acción) ejercida por un cuerpo sobre otro, éste opone, sobre aquél otra fuerza de igual intensidad y sentido contrario (reacción).
F = m x
a
Unidades:
N (newton) = kg m/seg2
Kg: kilogramo fuerza
1 Kg: 9,8 N
1 N: 0,102 kg
Trabajo: Cuando una fuerza aplicada a un cuerpo es capaz de moverlo, se dice que la fuerza realiza trabajo. El trabajo mecánico es el producto de la fuerza aplicada por la distancia recorrida en el mismo sentido que la fuerza.
Trabajo (L) = fuerza (F) x espacio recorrido (e)
Puede ocurrir que el espacio recorrido no tenga igual dirección que el de la fuerza aplicada, en este caso las direcciones del espacio recorrido y la fuerza aplicada determinan un ángulo.
Definimos trabajo como el producto de la
intensidad de la fuerza aplicada por el espacio y por el coseno del ángulo que
determina la dirección de la fuerza con la del espacio.
L = F e
cos α
Unidades:
L = N x m = J (Joule)
L = kg x m = kgm
(kilográmetro)
L = kw h = 367200
kgm
1 kgm = 9,8 J
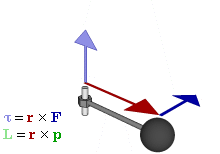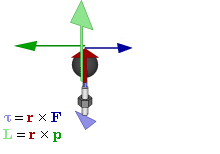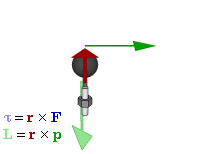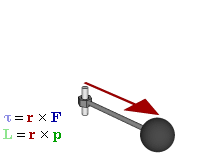
Par motor
Gráfico
dinámico que muestra la relación entre fuerza (F), par motor (τ),
momento lineal (p), momento angular (L) y posición (r) de una partícula
en rotación.
El par motor o torque es el momento de fuerza que ejerce un motor sobre el eje de transmisión de potencia o, dicho de otro modo, la tendencia de una fuerza para girar un objeto alrededor de un eje, punto de apoyo, o de pivote. La potencia desarrollada por el par motor es proporcional a la velocidad angular del eje de transmisión, viniendo dada por:
El par motor o torque es el momento de fuerza que ejerce un motor sobre el eje de transmisión de potencia o, dicho de otro modo, la tendencia de una fuerza para girar un objeto alrededor de un eje, punto de apoyo, o de pivote. La potencia desarrollada por el par motor es proporcional a la velocidad angular del eje de transmisión, viniendo dada por:
donde:
es la potencia (en W)
es el par motor (en N·m)
es la velocidad angular (en rad/s)
Potencia: Es el trabajo
desarrollado en la unidad de tiempo.
Pot = L / t
Unidades: Pot = J / seg. = w
(Watt)
Pot = kgm / seg.
Caballo vapor (CV):
es la potencia desarrollada al efectuar el trabajo de 75 kgm en un segundo.
1 CV = 75 kgm /
seg.
1 HP = 33000 lb pie / min.
1 HP = 1.014 CV 1CV = 0,986 HP
1 w = 0,102
kgm/seg. 1 Kw = 102
kgm/seg.
1 CV = 735 w =
0,735 Kw
Presión: Se define presión como la fuerza que actúa sobre cada unidad de superficie.
p = F / S
En los gases y los líquidos la presión la ejercen sobre la superficie de los recipientes que los contienen, y ésta se mide por medio de los manómetros.
En los líquidos la presión aumenta con la profundidad debido al peso de éstos.
Torricelli probó que si se practica un agujero en el fondo de un tanque de agua, ésta sale más rápidamente cuando el tanque esta lleno, y el régimen de flujo disminuye según el nivel de agua desciende. En otras palabras, según la columna de agua por encima de la abertura desciende, lo mismo sucede con la presión.
p = h x δ x g h: altura; δ: densidad; g: aceleración de la gravedad
La presión atmosférica es la presión del aire en la atmósfera debida a su propio peso. A nivel del mar, una columna de aire de una pulgada cuadrada de sección transversal y de una altura igual a la capa atmosférica, pesa 14,7 libras, la presión será de 14,7 lb/pulg2.
Para mayores alturas, la columna tiene menor peso, la presión es menor. Por debajo del nivel del mar, la presión atmosférica es superiora 14,7 psia.
La presión menor a la presión atmosférica se denomina vacío o vacío parcial. El vacío perfecto significa ausencia de presión.
El barómetro es el instrumento de medición de la presión atmosférica. Inventado por Torricelli, funciona: “cuando un tubo lleno de mercurio es invertido e introducido en un recipiente que también contenga mercurio, la columna en el tubo descenderá solamente una cierta distancia. La presión atmosférica sobre la superficie es la que soporta el peso de la columna de mercurio, con un vacío perfecto en la parte superior del tubo”.
Manómetro es un instrumento que mide presiones relativas a la atmosférica (presión de servicio), el cero en el instrumento indica que el fluido está a la presión atmosférica.
Unidades:
Kg/cm2 lb/pulg2 (psi)
p = N / m2 = Pascal
760 mmHg = 1,033 kg/cm2 = 1 atm
1kg/cm2 = 14,22 lb/pulg2
1 bar = 1,02 kg/ cm2 = 14,5 lb/pulg2
Presión absoluta y presión efectiva: la presión absoluta de un gas es la suma de la presión efectiva más la presión atmosférica. Cuando la presión que reina en un recinto se la refiere a la presión cero, o sea el vacío absoluto, se habla de presión absoluta; en cambio cuando se la refiere a la presión atmosférica se habla de presión efectiva. Por ejemplo: en una caldera reina una presión de 10 kg/cm2 absolutos significa que con respecto a un recipiente donde existe el vacío la presión en la caldera es de 10 kg/cm2, mientras que con relación a otro donde existe la presión atmosférica, la presión en la caldera es de 9 kg/cm2.
Temperatura: es el número que representa el estado térmico de un cuerpo, tomando como referencia un estado térmico perfectamente definido.
El aparato para medir las temperaturas se denomina termómetro.
Los termómetros presentan una escala termométrica, las cuales son:
a) La escala centígrada o Celsius
b) La escala Fahrenheit
Conversión de grados centígrados a grados Fahrenheit y viceversa
(temp. ºF – 32 )
Temp. ºC = _________________
1,8
Peso específico y densidad:
Peso específico: es el cociente entre el peso de la sustancia por la unidad de volumen.
Pe = P / V kg/dm3, gr/cm3
El peso específico de los cuerpos varía con la temperatura y con la presión. La variación de presión tiene muy poca influencia sobre el peso específico de los sólidos y líquidos pero en cambio influye apreciablemente sobre el peso específico de los gases que son muy compresibles.
Densidad: es el cociente entre la masa de un cuerpo y su volumen.
δ = m / V kg/dm3, gr/cm3
Relación entre densidad y peso específico:
Pe = P / V P = m x g
Pe = m x g / V m / V = δ
| Calor =energía |
El calor se mide en calorías* o en BTU**.
*Caloría=Unidad de energía térmica, de símbolo cal, que equivale a la cantidad de calor necesaria para elevar 1 grado centígrado la temperatura de 1 gramo de agua en condiciones atmosféricas normales.
**BTU (british thermal unit)=Unidad térmica, de símbolo BTU o BTu, que representa la cantidad de calor que se requiere para elevar en un grado Fahrenheit la temperatura de una libra de agua en condiciones atmosféricas normales.
Cantidad de calor: Si se acerca un cuerpo a una fuente de calor puede observarse los siguientes fenómenos:
a) o la elevación de su temperatura, es decir su calentamiento;
b) o su fusión; cambio de estado a temperatura constante;
c) o su vaporización, cambio de estado a temperatura constante.
Todos ellos motivados por la absorción de calor.
El agua, es la sustancia donde se dan los tres fenómenos, cuando se acerca una fuente de calor.
Si acercamos un mechero a un recipiente que contiene una mezcla de agua y hielo a 0º C, en la que sumergimos un termómetro. El primer fenómeno que se observa es que la cantidad de hielo disminuye a medida que el recipiente recibe calor, manteniéndose constante e igual a cero la temperatura mientras exista hielo en la mezcla; se trata del fenómeno de fusión.
Puede decirse que el hielo se ha fundido como consecuencia del calor que absorbió.
Al desaparecer la última partícula de hielo, la temperatura comenzará a elevarse hasta alcanzar 100º C. Durante éste período el calor absorbido por el agua provoca su elevación de temperatura; se trata de un calentamiento.
Finalmente, si seguimos calentando, la temperatura se mantendrá en 100º C pero el agua hierve desprendiendo vapores de su superficie. El calor absorbido se utiliza para hacer cambiar el estado del agua, la que pasa de líquido a estado gaseoso.
Podremos expresar que el calor es una forma de energía capaz de calentar los cuerpos.
La cantidad de calor que absorbe un cuerpo es directamente proporcional a su masa, a la variación de temperatura y al calor específico de la sustancia.
Q = m x ce x Δt
La unidad de cantidad de calor es la caloría que es la intensidad de calor que debe suministrarle a un gramo de agua para elevar su temperatura de 14,5º C a 15,5º C.
La más utilizada es la kilocaloría (kcal).
1 kcal = 3,959 BTU (British Thermal Unit)
1 BTU = 0,252 kcal.
Calor específico: Es la cantidad de calor que absorbe o cede un gramo masa de sustancia al aumentar o disminuir en un grado centígrado su temperatura.
En el caso de los gases se determina dos valores de calor específico cuyo calentamiento respectivamente es a volumen constante
Por ejemplo:
Sustancia
|
Calor
específico
|
|
A
presión constante
|
A
volumen constante
|
|
Aire
|
0.238
|
0.170
|
CO2
|
0.210
|
0.160
|
N2
|
0.247
|
0.176
|
Amoníaco
|
0.530
|
0410
|
Transmisión de calor: al pasaje de calor de un cuerpo o sustancia de mayor temperatura a otro de menor temperatura se lo denomina transmisión de calor. Las distintas formas, son:
A. Conducción: es la transferencia de calor por contacto directo entre dos cuerpos. La conducción del calor tiene lugar únicamente cuando las distintas partes del cuerpo se encuentran a temperaturas diferentes y la dirección del flujo calórico es siempre de los puntos de mayor a los de menor temperatura. Los materiales poseen un coeficiente de conductibilidad térmica, a mayor conductibilidad térmica, mayor es la cantidad de calor que pasa por unidad de tiempo.
B. Convección: es la transferencia de calor producida por el movimiento de los gases (aire) y líquidos. El aire al calentarse disminuye su peso específico volviéndose mas liviano; ascendiendo y el lugar que deja es ocupado por el aire más frío (> Pe) que a su vez se calienta repitiéndose el ciclo anterior. En el caso de los líquidos por ejemplo el agua en un recipiente; al calentarse el recipiente por su base, el agua de la parte más baja se calentará más rápidamente que la parte superior, haciéndose así más liviana que la restante y ascenderá en el recipiente. Por el contrario, el agua más fría descenderá para ocupar el lugar dejado por la que se desplaza hacia arriba. En ambos casos, gases y líquidos, se establece una corriente llamada “corriente convectiva”.
C, Radiación: es la transferencia de calor producida por la emisión de ondas electromagnéticas, dichas ondas se mueven a través del espacio o de los materiales a la velocidad de la luz, siendo absorbidas por los cuerpos que no son transparentes a ellas (cuerpos opacos).
Coeficiente de conductibilidad térmica: es la cantidad de calor (kcal.) que pasa en 1 hora a través de una pared construida con esa sustancia, cuya cara tenga 1 m2 de superficie, su espesor sea igual a 1 metro, cuando la diferencia de temperatura entre sus dos caras es de 1º C. La conductibilidad térmica varía de una sustancia a otra y para una misma sustancia depende de la temperatura, de su peso específico y de su humedad.
La conductibilidad térmica de los líquidos es muy pequeña y en los gases es nula.
Dilatación de los cuerpos por el calor: Al acercar un cuerpo a una fuente de calor pueden observarse varios fenómenos. En general se eleva su temperatura y la mayoría de sus propiedades físicas, dimensiones, volumen, calor específico, etc., se modifican.
No todos los cuerpos al ser calentados se dilatan. El caucho extendido, se contrae al ser calentado. Bajo la acción del calor la arcilla sufre una contracción que conserva después de haberse enfriado. El agua al ser calentada entre 0º C y 4º C también disminuye de volumen.
a) Dilatación de los sólidos: Al calentar un sólido sus dimensiones aumentan según todas las direcciones, creciendo así su superficie y su volumen. Estos poseen tres coeficientes: coeficientes de dilatación lineal, superficial y cúbica.
Aplicaciones: Pares bimetálicos, termostatos: El par bimetálico es un dispositivo constituido por dos láminas planas y delgadas de metales de distintos coeficientes de dilatación y sólidamente unidos. Cuando se calienta, el par se curva en un sentido, y al enfriarse vuelve a su posición primitiva llegando a curvarse en sentido contrario. La curvatura está regida por el metal de mayor coeficiente de dilatación; la curvatura por enfriamiento está provocada por el de menor coeficiente de dilatación. La diferencia de los coeficientes provoca un desplazamiento transversal en lugar del natural longitudinal.
Este principio permite la construcción de los termostatos, estos están destinados a abrir o cerrar (interruptores) circuitos eléctricos al alcanzarse determinadas temperaturas; se usan en heladeras, hornos, planchas eléctricas, etc. Cuando el par ha alcanzado la temperatura deseada, sufre la curvatura y se separa del borne provocando la interrupción del circuito.
b) Dilatación cúbicas de los líquidos: Los líquidos se expanden más que los sólidos y ejercen enormes presiones cuando se expanden al ser calentados en recipientes cerrados. Los líquidos poseen un coeficiente de dilatación cúbica.
Dilatación del agua: Si recordamos que un trozo de hielo a presión normal (760 mmHg), comienza a fundirse a los 0° C tendremos agua a dicha temperatura.
Al aumentar su temperatura por el calor que absorbe del medio, modifica su volumen del siguiente modo:
A 0° C su volumen es 1,000132 y su peso específico 0,99987
A 1° C su volumen es 1,000073 y su peso específico 0,99993
A 2° C su volumen es 1,000032 y su peso específico 0,99997
A 3° C su volumen es 1,0000078 y su peso específico 0,99999
A 4° C su volumen es 1,000000 y su peso específico 1,00000
A 5° C su volumen es 1,00008 y su peso específico 0,99992
A 6° C su volumen es 1,00027 y su peso específico 0,999727
Se observa que:
1. Entre 0° y 4° C el volumen del agua disminuye.
2. Superados los 4° C la dilatación se produce como ocurre en general en todos los líquidos.
3. El agua adquiere su mínimo volumen al llegar a los 4° C y por lo tanto su máxima densidad.
c) Dilatación de los gases: Si consideramos primero el caso en que la presión del gas permanece constante, para ello se encierra el gas en un recipiente provisto de un pistón cargado con una pesa (P), que recibe calor desde el exterior. Tendremos un coeficiente de dilatación a presión constante.
Si ahora el gas está encerrado en una esfera indeformable y de un metal que no se dilata por la acción del calor, al entregar calor al gas encerrado en esa esfera, como la misma no se deforma ni se dilata, la presión de aquel aumentará manteniéndose constante su volumen; coeficiente de dilatación a volumen constante.
Cambios de Estados
Vaporización: Es el pasaje del estado líquido al de vapor. Según las condiciones y forma en que se realice esa transformación el fenómeno se denominará: evaporación o ebullición.
Evaporación: Cuando se arroja agua sobre un piso, o se cuelga la ropa húmeda, en ambos casos notamos que pasa al estado vapor (se seca) sin observar otro detalle. Diremos que el líquido se ha evaporado. Los vapores del líquido se desprenden a partir de la superficie.
Ebullición: Cuando el agua o la leche hierven, se nota gran producción de burbujas que rompen en la superficie del líquido y que este fenómeno se produce en toda su masa, el líquido está en ebullición. Los vapores del líquido se desprenden en forma de burbujas que se producen en toda su masa.
Vapores saturados: Un vapor está saturado cuando en presencia de su líquido no admite que vaporice más líquido; o bien, un vapor está saturado cuando en presencia de su líquido y manteniendo constante la temperatura existe entre ellos un equilibrio (el líquido no se vaporiza y el vapor nos se condensa).
Todo vapor saturado ejerce una presión determinada llamada tensión de vapor saturado, dicha tensión varia con la temperatura (a mayor temperatura mayor tensión de vapor) y con la naturaleza de la sustancia.
Leyes de ebullición:
1° Ley: Todo líquido entra en ebullición a una determinada temperatura, para un valor dado de la presión. A esa temperatura se la denomina punto de ebullición.
2° Ley: Durante la ebullición, la temperatura permanece constante. Esto ocurre porque todo el calor que se entrega lo emplea en la transformación de líquido en vapor y no lo absorbe.
3° Ley: Un líquido entra en ebullición cuando la tensión de su vapor saturado es igual a la presión que soporta.
Causas que aceleran o retardan la ebullición:
a) Los líquidos sin gases disueltos tardan más en hervir. Así, una masa de agua calentada a más de 100° C no hierve, y si le hacemos llegar más burbujas de aire, observamos que entra inmediatamente en ebullición.
b) Cuando el líquido posee sustancias en disolución se produce un aumento del punto de ebullición.
En consecuencia la falta de gases en los líquidos retarda su ebullición.
La temperatura de ebullición del agua depende de la presión a que se encuentra sometida, correspondiendo a cada presión una temperatura única y bien determinada.
Temperatura normal de ebullición a 760 mmHg:
Aire -194° C
Amoníaco -33,4° C
Agua 100° C
Parafina 300° C
Sea un recipiente en el cual hay 1kg de agua en estado líquido y a 0° C. Para que sobre ella actúe un presión p kg/cm2 cargaremos al pistón con una pesa (P) de modo P/S = p, S = sección del cilindro (cm2).
Suministrando calor al agua, su temperatura aumentará hasta alcanzar la de ebullición correspondiente a la presión a la que se encuentra sometida. Por ejemplo: p = 5kg/cm2, el termómetro marca 152,1° C.
Al ser calentada el agua se dilata, pero en una cantidad muy pequeña. Llegada la temperatura de ebullición todo calor que reciba a partir de aquí se empleara para transformar el líquido en vapor.
La temperatura no ascenderá manteniéndose constante, pero podrá observarse que el pistón se desplaza empujado por el vapor manteniéndose constante la presión ya que el peso que actúa sobre él no ha variado.
Vapor seco: Si en el momento que desaparece la última gota de agua se deja de suministrar calor, el vapor así obtenido se designa con el nombre de “vapor seco”. Este vapor tiene la misma presión y temperatura que la del agua que le dio origen.
Calor de vaporización: El calor gastado para convertir 1kg de agua a la presión (p) y a temperatura de ebullición correspondiente a esa presión, en vapor seco a la misma presión y temperatura se llama calor de vaporización.
Calor total de un vapor: Llámese así a la suma del calor del líquido más el calor de vaporización, es decir, el calor necesario para convertir 1kg de agua tomada a la temperatura de 0° C y presión (p), en vapor seco a la misma presión.
Si en vez de partir de agua a 0° C se utiliza a mayor temperatura, como el caso en calderas, habrá que gastar menos calor para producir vapor seco, pues el agua trae consigo una cierta cantidad de calor que no será necesario entregarle desde una fuente exterior.
Vapor Húmedo: Es el vapor que lleva en suspensión gotas de agua.
Vapor Sobrecalentado: Siguiendo con lo descrito en el punto de producción de vapor de agua, supongamos que nos encontramos en el momento en que desaparece la última gota de agua, al seguir calentando se observa que crece la temperatura y también el volumen de vapor pues el pistón se sigue desplazando. La presión que actúa sobre el vapor es siempre la misma ya que no se cambió el peso (P). Por ejemplo: si la presión fuese de 10 kg/cm2 la temperatura de vaporización será de 181,2° C, temperatura que existía al desaparecer la última gota de agua. Al seguir suministrando calor, el vapor encerrado en el recipiente alcanzará por ejemplo la temperatura de 250° C siendo su presión siempre de 10 kg/cm2.
Un vapor cuya temperatura es superior a la de vaporización correspondiente a la presión a que se encuentra sometido recibe el nombre de vapor sobre calentado.
El calor total de un vapor sobrecalentado es igual al calor del líquido más el calor de vaporización más el calor de sobrecalentamiento.
El término vapor recalentado se refiere a aquel que se ha vuelto a calentar después que ha pasado por una máquina.
Título o calidad de un vapor: Por su definición, los vapores saturados pueden considerarse como una mezcla de líquido y vapor seco. Se denomina título o calidad de un vapor húmedo a la cantidad (peso) de vapor seco que contiene 1kg de vapor húmedo. Así por ejemplo decir que el título de vapor es 0,8 (80%) significa que en 1kg de vapor húmedo hay 0,800 kg de vapor seco y 0,200 kg de agua.
Se indica con la x y su valor está comprendido entre 0 y 1. Si x = a 0, el fluido se hallará íntegramente en estado líquido; para x = 1 por el contrario, estará completamente vaporizado, en la condición de vapor seco.
Combustibles – Combustión
La combustión es un proceso químico durante el cual se produce la unión de elementos combustibles con el oxígeno con desprendimiento de calor.
La combustión está formada por: el combustible (sustancia que se quema), el oxígeno llamado comburente y una temperatura suficientemente elevada que está en función de la temperatura de ignición del combustible. Dicha fuente de temperatura puede ser la llama de un quemador.
El calor gasifica el combustible (ningún combustible quema antes de haberse convertido en gas) y el aire le proporciona el oxígeno necesario para la combustión.
El aire es una mezcla de oxígeno, nitrógeno y una pequeña cantidad de gases; por ello sin cometer error podemos decir que el aire está compuesto de oxígeno y nitrógeno. De estos dos elementos, solo el oxígeno participa en la combustión, el nitrógeno es un gas inerte que no quema, llega al hogar y sale a elevada temperatura arrastrando hacia el exterior el calor, lo cual es perjudicial desde el punto de vista del rendimiento del hogar.
Los principales elementos contenidos en los combustibles utilizados en los hogares de las calderas son: el carbono (C), el hidrógeno (H2), el azufre (S), el nitrógeno (N2), el oxígeno (O2), humedad y cenizas.
Cada componente del combustible al quemarse de origen:
a) El C con suficiente aire produce anhídrido carbónico (CO2) en una combustión completa. O en el caso de insuficiencia de aire (combustión incompleta) genera monóxido de carbono (CO).
b) El hidrógeno al combinarse con el aire genera vapor de agua, el que sale por la chimenea.
c) El azufre produce anhídrido sulfuroso
d) El nitrógeno no quema (gas inerte)
e) La humedad es agua, por lo que no se quema sino que se vaporiza absorbiendo calor.
f) Las cenizas no se queman, son sustancias incombustibles.
Clasificación de los combustibles:
Según su estado tendremos combustibles:
Sólidos
Natural
Manufacturado
Turba Hulla Lignito Antracita Leña Coque Carbón de leña Briquetas
Líquidos y gaseosos: derivados del petróleo
Oxígeno necesario para la combustión:
Los químicos deducen:
a) 16 grs. de oxígeno se unen a 2 grs. de hidrógeno para dar 10 grs. de agua, por consiguiente por cada gramo de hidrógeno necesito 8 grs. de oxígeno.
b) 32 grs. de oxígeno se unen a 12 grs. de carbono para dar 44 grs. de anhídrido carbónico, por consiguiente por cada gramo de carbono se necesitan 2,66 grs. de oxígeno.
c) 16 grs. de oxígeno se unen a 12 grs. de carbono para dar 28 grs. de monóxido de carbono.
d) 32 grs. de oxígeno se unen a 32 grs. de azufre para dar 64 grs. de anhídrido sulfuroso.
e) 16 grs. de oxígeno se unen a 28 grs. de monóxido para dar 44 grs. de anhídrido de carbono.
Aire necesario para la combustión: La combustión en el hogar se realiza con aire, por lo tanto, debe penetrar una cantidad de aire que contenga el oxígeno necesario para dicha combustión.
Sabemos que 1 kg de aire contiene 230 gr de O2, del ejemplo necesitamos 3416,2 gr de O2 por lo tanto la cantidad de aire será:
No sólo basta para obtener una buena combustión disponer de combustible y del aire necesario, sino que es importante que cada particular o elemento de combustible encuentre la cantidad de oxígeno que necesita para quemar. Para ello debe existir una mezcla homogénea entre el aire y el combustible lo que se consigue fácilmente en el caso de los combustibles gaseosos y líquidos.
Para poder quemar totalmente un kilogramo de combustible debe existir en el hogar mayor cantidad de aire que lo que resulta del cálculo, o sea debe haber exceso de aire; este depende no sólo del tipo de combustible sino también del tipo de hogar.
Poder Calorífico: Se entiende por poder calorífico de un combustible al calor desprendido durante la combustión completa de un kilogramo del mismo si es sólido o líquido y de un metro cúbico si es gas a la presión de 760 mmHg y a 0º C.
Unidades: kcal/kg (sólidos y líquidos)
Kcal/m3 (gases ---- m3n P, T normal)
Sabemos que todo combustible que contiene hidrógeno en sus productos de la combustión hay presencia de vapor de agua. En las determinaciones experimentales del poder calorífico, los productos de la combustión son enfriados generalmente hasta una temperatura para la cual el vapor de agua que contiene se condensa, en esa forma, el calor latente de vaporización de este último se suma al de combustión.
En consecuencia, para un mismo combustible y siempre que contenga hidrógeno podrá hablarse de su poder calorífico inferior cuando el agua originada por la combustión permanezca en estado de vapor (PCI: el vapor de agua de los humos no condensa), y de su poder calorífico superior cuando aquella se haya licuado (PCS: se condensa el vapor de agua de los humos).
Cantidad de calor que produce un combustible Q
Q = G (kg/h) x Pc (kcal/kg) = Kcal/h G: caudal de combustible (consumo)
Temperatura de inflamación (Punto Flash): Es la menor temperatura a la que hay que elevar un combustible para que se desprendan vapores que formen con el aire una mezcla que se inflama al acercase una llama o fuente de ignición (la combustión no continúa al retirar la llama). Existen dos métodos de obtención: a vaso abierto (aparato Cleveland) y a vaso cerrado (aparato Pensky – Martens o el de Tagliaue).La temperatura de inflamación es un indicativo de la peligrosidad de un combustible. Cuanto más bajo sea el punto de inflamación más fácilmente desprenderá vapores un combustible.
Temperatura de combustión o ignición: Si se continúa calentando el combustible sobre su temperatura de inflamación encontraremos una temperatura a la cual la velocidad de desprendimiento de vapores es tal que una vez que se inicia la combustión (al acercarse una llama) la misma continúa aunque se aparte esta. Se denomina temperatura de ignición o combustión a la temperatura mínima correspondiente a la iniciación de una combustión continuada y completa de los vapores desprendidos del combustible, luego de retirar la fuente de ignición (llama).
Temperatura de autoignición o autocombustión: Es la mínima temperatura a la cual debe elevarse una mezcla de vapores inflamables y aire, para que se encienda espontáneamente sin necesidad de la presencia de una fuente de ignición externa. Suele ser muy superior a las anteriores.
Análisis y prueba de los combustibles
Las características físicas y constitución del combustible deben conocerse por dos causas:para asegurarse que el combustible satisfaga las especificaciones requeridas, y
para suministrar información que permita al personal manejar y quemar el combustible en forma más eficiente.
Las características más importantes son:
a) Punto de inflamación
b) Punto de ignición
c) Viscosidad
d) Densidad específica
e) Porcentaje de impurezas
f) Poder calorífico
g) Contenido de cenizas
h) Tendencia a obstruir tuberías, calentadores, etc.
i) Estabilidad al almacenamiento
j) Punto de fluidez
Viscosidad: Es la medida de la resistencia de un líquido a fluir. Dentro de los métodos de obtención de la viscosidad, el más común es el de medir el tiempo que necesita una cantidad definida de líquido a una temperatura determinada para fluir por un orificio patrón. La viscosidad se expresa en función del tiempo en segundos requeridos para este proceso, este instrumento es el Viscosímetro y el más usado es el Viscosímetro Saybolt, siendo la cantidad medida como 60cm3 estableciéndose la viscosidad en s.s.u. (segundos saybolt universal).
Densidad específica: Es la relación entre el peso de un volumen dado de una sustancia cualquiera, y el peso de un volumen igual de agua en condiciones standard de presión y temperatura (para combustibles, presión atmosférica y temperatura de 60º F). La densidad específica se determina por medio de un densitómetro. Este instrumento consta esencialmente de un tubo hueco cerrado en ambos extremos y lastrado en uno de ellos, de modo que al sumergirse dentro del líquido flota en posición vertical. Una escale está colocada a un lado del tubo (o grabada) para medir la profundidad a la cual se sumerge, estando la calibración de la escala en función de la densidad específica.
Se usan distintas escalas, siendo la más común la de API (American Petroleum Institute). En dicha escala la densidad específica del agua es establecida a 10.0 grados API a una temperatura de 60º F. Sobre esta base cualquier producto que tenga una densidad específica mayor de 10.0 grados API es más ligera que el agua y cualquier producto que tenga una densidad específica menor de 10.0 grados es más pesada que el agua.
Los resultados de cualquier prueba de densidad son mayor importancia en la identificación de productos.
Porcentajes de impurezas: El agua y los sedimentos son los más comunes, se determina por medio de: 1) destilación y/o 2) por centrifugación. En éste último método, una muestra de combustible que se va a probar se diluye en una cantidad igual de Benzol, y se colocan 100 cm3 de la mezcla en un tubo graduado, este tubo se coloca en el aparato centrifugador y se hace girar durante un tiempo determinado.
El agua y sedimento, por ser más pesados que el combustible son separados de éste en virtud de la fuerza centrífuga y se asienta en el fondo del tubo. Las cantidades de cada uno se leen entonces en las graduaciones del tubo. El agua en el combustible es indeseable debido a que provoca la emulsificación e interfiere la combustión adecuada. El sedimento causa desgaste en las válvulas de la bomba y quemadores, y obstruye los orificios de los quemadores.
Contenido de cenizas: Se determina quemando una muestra de combustible en un recipiente cerrado hasta que sólo quedan cenizas. Las cenizas son los constituyentes incombustibles del combustible.
Tendencia a obstruir: depende de:
a) La naturaleza del petróleo crudo original del cual se deriva el combustible.
b) En el caso de los combustibles mezclados; el tipo de residuo usado, el tipo de aceite usado y el método de mezcla.
c) El tiempo que ha estado almacenado ya que esto afecta la vaporización de los elementos volátiles.
d) La cantidad de carbonización causada por el calentamiento del combustible (petróleo) para facilitar su bombeo desde los tanques de almacenaje a través de tuberías, calentadores, etc.
La suciedad excesiva restringe el flujo de combustible por los quemadores y afecta la posibilidad de utilizar toda la potencia de la caldera.
Estabilidad en el almacenaje: Depende principalmente de los métodos de mezcla, ya que la mezcla impropia puede ocasionar la separación de los elementos más densos, que formarán lodo en el tanque de almacenamiento. Los combustibles no mezclados, tales como los petróleos crudos y los combustibles residuales de destilación, son generalmente estables. La formación de lodo causa obstrucción en las tuberías, filtros, y quemadores, da como resultado un desperdicio considerable.
Punto de fluidez: De un aceite o combustible es la temperatura a la cual se congela cuando se enfría. El combustible debe permanecer en estado de fluidez a la temperatura más baja. El punto de fluidez se determina simplemente enfriando lentamente y anotando la temperatura a la cual ya no puede fluir.
___________________________________________________________________________________
ENTRADAS RELACIONADAS
- Par de apriete
- Par de fuerzas
- Par motor
- Momento de fuerza
- Presión-Unidades de presión y sus factores de conversión
- Fuerza
FUENTES:
M.J.D.
MAQ 303 Calderas Navales.